AULA TEÓRICA 10 – Células troncos
Na aula de hoje a professora Cláudia nos deu uma aula sobre células tronco. Ela nos mostrou como o esse estudo é relativamente recente e como é dinâmico. Alguns termos usados a poucos anos atras já estão ultrapassados. Foi uma das aulas mais legais que eu tive na faculdade.
As células-tronco, também conhecidas como células-mãe ou células estaminais, são células que possuem a melhor capacidade de se dividir dando origem a células semelhantes às progenitoras.
As células-tronco dos embriões têm ainda a capacidade de se transformar, num processo também conhecido por diferenciação celular, em outros tecidos do corpo, como ossos, nervos, músculos e sangue. Devido a essa característica, as células-tronco são importantes, principalmente na aplicação terapêutica, sendo potencialmente úteis em terapias de combate a doenças cardiovasculares, neurodegenerativas, diabetes tipo-1, acidentes vasculares cerebrais, doenças hematológicas, traumas na medula espinhal e nefropatias.
O principal objetivo das pesquisas com células-tronco é usá-las para recuperar tecidos danificados por essas doenças e traumas. São encontradas em células embrionárias e em vários locais do corpo, como no cordão umbilical, na medula óssea, no sangue, no fígado, na placenta e no líquido amniótico. Nesse último local, conforme descoberta de pesquisadores da Escola de Medicina da Universidade de Wake Forest, no estado norte-americano da Carolina do Norte, noticiada pela imprensa mundial nos primeiros dias de 2007.
fonte: http://pt.wikipedia.org/wiki/C%C3%A9lula-tronco
Abaixo um texto q aborda aspectos importantes sobre células tronco e as dificuldades encontradas para usá-las.
| Obstáculos no caminho que leva da promessa terapêutica aos tratamentos reais em seres humanos | ||||||
| por Robert Lanza e Nadia Rosenthal | ||||||
|
Como acontece com frequência em ciência, a pesquisa com células-tronco gerou tantas perguntas novas quanto as que respondeu, mas o campo vem avançando. Testes preliminares com células-tronco humanas adultas no tratamento de doenças cardiovasculares estão produzindo resultados encorajadores e certamente conduzirão a testes mais abrangentes. Testes terapêuticos de derivadas de células TE humanas em doenças neurodegenerativas provavelmente são iminentes. As células-tronco trazem a possibilidade de regenerar partes debilitadas do corpo e de curar doenças que ainda desafiam os tratamentos com drogas. Os pacientes se enchem de esperança com os relatos das propriedades quase miraculosas dessas células, mas muitos dos estudos científicos mais comemorados foram refutados posteriormente, e outros dados foram distorcidos em debates não sobre a técnica, mas sobre a moralidade de retirar essas células de embriões humanos. Alegações provocativas e conflitantes deixam o público (e a maioria dos cientistas) confusos quanto à viabilidade de tratamentos com células-tronco. Caso as restrições legais e de financiamento nos EUA e em outros países fossem removidas de imediato, os médicos seriam capazes de começar tratamentos com células-tronco no dia seguinte? Provavelmente não. Muitos obstáculos técnicos precisam ser superados e muitas questões sem resposta precisam ser solucionadas antes de podermos utilizar as células-tronco com segurança. Por exemplo, a simples identificação de uma célula-tronco verdadeira pode ser complicada. Precisamos primeiro saber se as células em estudo realmente possuem a capacidade de atuar como a fonte, ou como o “tronco”, para outros tipos de célula, enquanto permanecem em estado genérico. Mas, mesmo com exames minuciosos e exaustivos, não é possível distingui-las por sua aparência. É seu comportamento que as define. |
||||||
| As mais versáteis são as células-tronco embrionárias (TE), isoladas pela primeira vez em camundongos há mais de 20 anos. As células TE vêm da região de um embrião muito jovem que, no desenvolvimento normal, forma as três camadas germinativas distintas de um embrião mais maduro e, em última análise, todos os diferentes tecidos do corpo. Células TE retêm esse potencial para produzir qualquer tipo de célula no organismo, o que as torna pluripotentes.
A maioria das linhagens de células TE humanas existentes no mundo foram derivadas de embriões criados por fertilização in vitro. Descobriu-se que elas podem se diferenciar em diversos tipos de célula em uma placa de cultura, mas está cada vez mais claro que nem todas as linhagens de células TE humanas são iguais. Algumas linhagens se diferenciam em apenas certos tipos de células; outras crescem lentamente no meio de cultura. A fim de garantir que essas células sejam pluripotentes antes de utilizá-las em pesquisas, um grupo de biólogos americanos e canadenses propôs dois tipos de teste, que já são comuns em estudos de células TE não-humanas. Um deles envolve a injeção de células TE no tecido de um animal; caso se forme um teratoma (um tumor característico, contendo células de todas as três camadas embrionárias), fica comprovada a sua pluripotência. Outra forma de testar supostas células TE consiste em marcá-las e depois injetá-las em um embrião em desenvolvimento. Quando o animal nasce, se as células marcadas aparecerem em todos os seus tecidos, a linhagem é considerada pluripotente. O teste de células-tronco embrionárias humanas dessa forma, entretanto, criaria um animal quimérico, com DNA humano espalhado por seu organismo, perspectiva que muitos acham eticamente desconfortável. E mais: o fato de as células passarem por esse último teste nem sempre garante que irão se diferenciar em laboratório. |
||||||
| Conversa com Neurônios
QUANDO SÃO SIMPLESMENTE LARGADAS em uma placa de cultura, as células TE se diferenciam espontaneamente em uma miscelânea de tecidos. Com produtos químicos, freqüentemente conseguimos levá-las a se transformar em um tipo específico de célula. Mas elas parecem preferir certos tecidos – viram facilmente aglomerados de células cardíacas que batem, por exemplo -, enquanto outros são muito mais difíceis de produzir. Como ainda não entendemos os sinais que instruem as células a escolher determinado caminho durante o desenvolvimento embrionário, os pesquisadores vêm estudando seu “nicho” natural, a fim de entender possíveis indícios ambientais. Mas derivar células é apenas metade da batalha. Células TE podem produzir com facilidade placas cheias de neurônios, por exemplo, mas eles só terão utilidade se puderem ser inseridos em um cérebro vivo, criando conexões e “conversando” com os neurônios a seu redor. Em 2001, os pesquisadores acreditaram ter conseguido um grande avanço quando Ronald McKay, dos Institutos Nacionais de Saúde, relatou ter gerado células produtoras de insulina (importante objetivo na pesquisa de células-tronco) a partir de células TE de camundongos. No ano passado, no entanto, Douglas A. Melton, da Universidade Harvard, reproduziu o experimento de McKay e descobriu que as células haviam absorvido insulina do meio de cultura, em vez de produzi-la. O ideal seria injetar células TE na parte do organismo que necessita de regeneração, deixando que elas obtenham as informações necessárias do ambiente. A pluripotência das células TE, no entanto, torna essa alternativa perigosa demais para terapias em seres humanos. As células poderiam formar um teratoma, ou se diferenciar em um tipo de tecido indesejável, ou ambos. Em experimentos com animais, existem diversos relatos de teratomas com dentes totalmente formados. Em vez de se arriscar a criar um tumor ou um dente no cérebro ou no coração de um paciente com injeções diretas de células TE, ou de tentar produzir tecidos funcionais específicos, muitos pesquisadores vêm buscando um meio-termo. Ao forçar as células TE a assumir um estágio progenitor mais estável, mas ainda flexível, antes de usá-las, somos capazes de evitar a diferenciação descontrolada, ao mesmo tempo que conseguimos tirar vantagem das informações ambientais para a geração das células desejadas. |
||||||
| Mesmo quando essas células pro-genitoras conseguem se ambientar e iniciar a geração de novos tecidos, ainda estão sujeitas ao ataque do próprio organismo do paciente. Elas têm a mesma probabilidade de rejeição de um órgão transplantado, pois possuem proteínas de superfície, ou antígenos, que permitem que o sistema imune reconheça invasores. Centenas de combinações de diferentes tipos de antígenos são possíveis, o que significa que, para a criação de um banco de células com combinações imunológicas adequadas à maioria dos pacientes, seriam necessárias centenas de milhares de linhagens, e isso exigiria milhões de embriões descartados de clínicas de fertilização.
Alguns pesquisadores especulam que isso não seria necessário, pois é possível insensibilizar pacientes às derivadas das células TE, ou ainda reduzir as propriedades antigênicas das próprias células. Todavia, isso ainda não foi demonstrado. No momento, a única forma segura de evitar o problema da rejeição imunológica é a criação de uma linhagem de células TE com material genético do próprio paciente, por meio de transferência nuclear, ou clonagem. Essa técnica já gerou considerável controvérsia e terá de superar seus próprios obstáculos de ordem prática, mas também já produziu resultados enco-rajadores na geração de tecidos deficientes em experimentos com animais. A clonagem pode ser vista como uma forma de restaurar o potencial embrionário das células adultas de um paciente. O corpo humano é composto por mais de 200 tipos de célula, e, nos mamíferos, uma vez que uma célula se diferencia em um deles, não há como voltar atrás. Chamamos esse tipo de célula de “terminalmente diferenciada”. Uma exceção é quando o núcleo, contendo o material genético de um óvulo não-fertilizado, é extraído, sendo substituído pelo núcleo de uma célula somática (não-sexual), implantado no óvulo. Este passa a se comportar como se tivesse sido fertilizado, começando a divisão, como um embrião normal. As células TE derivadas desse embrião contêm o DNA da célula somática do doador, que terá sido reprogramada – restaurada a um estado de pluripotência. Um de nós (Lanza) recentemente demonstrou que células-tronco parcialmente diferenciadas de um embrião de camundongo clonado podem ser injetadas no coração do camundongo doador. Elas foram ao ponto danificado por um ataque cardíaco e substituíram 38% do tecido cicatrizado por tecido cardíaco saudável em um mês (ver ilustração acima). Neste ano, pela primeira vez, a transferência nuclear de células somáticas, ou SCNT, na sigla em inglês, produziu uma linhagem de células TE humanas. Woo Suk Hwang e colegas da Universidade Nacional de Seul anunciaram ter conseguido, através de SCNT, criar um embrião humano, cultivado até se tornar um blastocisto, gerando uma linhagem pluripotente de células TE. |
||||||
| Mutação Genética
COMO A EQUIPE DE HWANG dispunha de 242 óvulos doados, eles foram capazes de experimentar, a cada passo, com diversas técnicas, ritmos e condições. Mesmo assim, conseguiram apenas uma única linha de célula TE – e os pesquisadores não estão seguros sobre qual dos métodos foi o responsável pelo sucesso. Os cientistas ainda não sabem se a reprogramação ou algum outro aspecto da manipulação desses embriões poderiam introduzir mutações genéticas que predisponham as células TE ao envelhecimento ou ao câncer. Mutações genéticas hereditárias, como as que causam hemofilia ou distrofia muscular, também teriam de ser corrigidas antes de as células do próprio paciente serem empregadas para a criação de células TE. No entanto, técnicas para modificações específicas do gene defeituoso, conduzidas rotineiramente em células TE de camundongos, já foram aplicadas com sucesso a células TE humanas. A saúde das células TE derivadas de embriões clonados também é questionada, uma vez que experiências desse tipo esbarram em uma taxa muito elevada de deformidades e mortalidade. No entanto, quando o potencial de uma linhagem de células TE clonadas é testado, através da injeção das células em um blastocisto em desenvolvimento, os animais resultantes são normais. Isso sugere que, embora a clonagem reprodutiva seja imprevisível demais para ser usada em seres humanos, as células TE derivadas por meio de transferência nuclear são equivalentes a células TE normais, pelo menos para fins terapêuticos. Problemas de segurança parecidos também precisam ser solucionados em outra técnica que produz células TE. Em um processo chamado partenogênese (em grego, “concepção virgem”), um óvulo não-fertilizado pode ser quimicamente induzido a iniciar divisão celular. Esses pseudo-embriões, ou partenotas, são consideravelmente mais fáceis de cultivar que embriões criados por transferência nuclear. Em estudo com animais, partenotas produziram células TE capazes de se diferenciar em muitos tecidos em cultura, e de passar no teste do teratoma, formando células com todas as três camadas germinativas embrionárias. |
||||||
| Ao contrário do que acontece com células normais do corpo, que contêm um conjunto de cromossomos de cada genitor, as partenotas têm um conjunto duplicado dos cromossomos do doador do óvulo. Isso lhes garante um conjunto completo de genes, mas impede sua viabilidade caso seja implantado no útero. Ter um único genitor também significa que as células partenotas carregam metade das potenciais combinações de antígenos, tornando-as muito mais fáceis de serem aceitas pelos pacientes. Um banco com menos de mil linhagens de células TE partenogênicas provavelmente seria suficiente para gerar combinações imunológicas adequadas para a maior parte da população dos EUA.
O tempo para que qualquer tipo de terapia de célula TE seja testado em humanos será determinado não somente por questões científicas ainda sem resposta, mas também por questões políticas. Algumas linhagens derivadas de células TE, mais bem compreendidas e de fácil controle, como neurônios produtores de dopamina ou células epiteliais de pigmento retinal ocular, poderiam estar disponíveis para testes em humanos em menos de dois anos. Enquanto isso, o extraordinário potencial das células-tronco embrionárias vem intensificando a busca por células similares que possam estar envolvidas no processo normal de cura do corpo adulto. Potencial Oculto A PELE COMEÇA A SE CONSERTAR logo depois de sofrer qualquer dano. O fígado humano é capaz de regenerar até 50% de sua massa em semanas, similar ao que acontece com a salamandra, que cria um novo rabo para substituir o perdido. Nossos glóbulos vermelhos são substituídos a uma taxa de 350 milhões por minuto. Sabemos que as prolíficas células-tronco devem estar trabalhando em tecidos com capacidade de regeneração tão rápida. Mas há questões quanto a outros órgãos, como o cérebro e o coração, serem capazes de auto-reparo significativo, principalmente porque células que aparentam ser células-tronco também foram recentemente descobertas naqueles tecidos. As células-tronco mais conhecidas do organismo adulto são as hematopoiéticas, encontradas na medula óssea, fontes de mais de meia dúzia de tipos de células sangüíneas. Sua capacidade de gerar essa variedade, pelo menos dentro de uma família específica de tecido, explica por que já foram descritas como multipotentes. Existem grandes esperanças de que células-tronco multipotentes similares, encontradas em outros tecidos do organismo, possam ser induzidas a reparar danos, sem que seja necessária a utilização de embriões – ou, melhor ainda, que uma célula-tronco adulta com maior versatilidade, próxima da pluripotência das células embrionárias, possa ser descoberta. |
||||||
| Mas os cientistas apenas começam a investigar se a regeneração natural fica, de alguma forma, bloqueada em tecidos que não se auto-regeneram facilmente e se o desbloqueio de sua capacidade regenerativa é possível. Ainda não se sabe se a própria fonte, bem como o potencial de diversas células-tronco adultas, específicas para tecidos, originam-se dentro deles ou descendem das hematopoiéticas. Tampouco sabemos até que ponto essas células podem ser forçadas a se diferenciar em tecidos funcionais que não o seu, ou se tal transdiferenciação poderia ser reproduzida em um organismo vivo.
A idéia de que certas células-tronco adultas podem ter esse potencial surgiu depois de transplantes de medula óssea em humanos, quando células doadoras foram encontradas em uma vasta gama de tecidos dos receptores. Assim, sob condições adequadas, as células-tronco da medula óssea poderiam contribuir com virtualmente qualquer parte do organismo. (Alegações parecidas já foram feitas sobre as chamadas células-tronco fetais, encontradas no sangue do cordão umbilical, similares a células-tronco hematopoiéticas.) Os testes feitos diretamente em organismos vivos, no entanto, mostraram pouca evidência de tal plasticidade. Em março, relatos da equipe de Leora Balsam, da Universidade Stanford, e de outra liderada por Charles E. Murry, da Universidade de Washington, descreveram a utilização de potentes métodos de rastreamento a fim de determinar se as células-tronco hematopoiéticas seriam incorporadas a músculos cardíacos danificados, um tecido não-hematopoiético. Nenhum dos grupos detectou a presença de antigas células-tronco nos novos tecidos. O que se nota com freqüência cada vez maior é a fusão de células-tronco da medula óssea com células do coração, do fígado e do cérebro, sugerindo uma explicação alternativa para a suposta transdiferenciação. Em estudos futuros, será crucial descartar a possibilidade de as células-tronco simplesmente se fundirem às células do local tratado, em vez de gerarem novas. |
||||||
| Ainda assim, células-tronco de tecidos específicos já produziram resultados encorajadores. No estudo alemão Topcare-Ami, com pacientes com severo dano cardíaco causado por infarto do miocárdio, células progenitoras cardíacas dos próprios pacientes foram injetadas diretamente na área danificada. Quatro meses mais tarde, o tecido danificado havia diminuído quase 36% em tamanho, e a capacidade cardíaca dos pacientes, aumentado 10%.
O pequeno número de células-tronco que pode ser isolado em qualquer tecido adulto continua a ser o maior entrave técnico. Na medula óssea de camundongos, células-tronco são raras, apenas uma em 10 mil, e essa proporção pode ser ainda menor em humanos. O cultivo de células-tronco adultas também é sabidamente lento e trabalhoso. Assim como as células embrionárias, sabemos tão pouco sobre os fatores que podem controlar seu desenvolvimento que ainda não temos como prever se um período prolongado em cultura pode causar danos à sua capacidade de restaurar tecidos. Em vez de caçar as células-tronco de um paciente para removê-las, cultivá-las e reimplantá-las, talvez possamos utilizar suprimentos ocultos do organismo. Evidên-cias sugerem que as células-tronco, tal como as células de tumores metastáticos, respondem a sinais químicos comuns, levando-os até o local danificado. Um de nós (Rosenthal) recentemente demonstrou em camundongos que as células-tronco são capazes de viajar grandes distâncias para chegar a um ferimento, com o auxílio de uma proteína chamada IGF-1 (ver ilustração acima). Usar a capacidade do próprio corpo de dar início à regeneração de tecidos vai exigir uma melhor compreensão dos papéis de tais sinais químicos. A equipe de Rosenthal já demonstrou que a IGF-1 ajuda a convocar as células-tronco, mas suspeitamos que essa molécula também possa desempenhar papel na reversão de algumas das células danificadas para um estado multipotente, com subseqüente diferenciação nos tecidos necessários. O fenômeno, conhecido como regeneração epimórfica, é a base para a incrível capacidade de salamandras e certos peixes de gerar membros e órgãos inteiros para reposição. |
||||||
| O ideal da medicina regenerativa seria encontrar uma forma de ativar esse tipo de desdiferenciação controlada de tecido adulto – em essência, transformar uma célula terminalmente diferenciada em célula-tronco. Muitos pesquisadores estão procurando as moléculas mágicas capazes de produzir tal transformação, e alguns êxitos de caráter bastante preliminar foram relatados recentemente. Entretanto, a regeneração terapêutica por meio da desdiferenciação ainda está muito distante de ser realidade, e provavelmente virá de uma compreensão muito mais profunda das próprias células-tronco, tanto adultas como embrionárias, e de sua qualidade de “tronco”.
Como acontece com frequência em ciência, a pesquisa com células-tronco gerou tantas perguntas novas quanto as que respondeu, mas o campo vem avançando. Testes preliminares com células-tronco humanas adultas no tratamento de doenças cardiovasculares estão produzindo resultados encorajadores e certamente conduzirão a testes mais abrangentes. Testes terapêuticos de derivadas de células TE humanas em doenças neurodegenerativas provavelmente são iminentes. Enquanto a fonte adequada de células, tanto para pesquisas como para eventuais aplicações terapêuticas, continuar a ser exaustivamente debatida, restrições nas pesquisas atrasarão o seu progresso. Mas acreditamos que a geração de células de reposição e de órgãos regenerativos são objetivos viáveis e realistas. Os obstáculos são difíceis, mas não intransponíveis. |
||||||
AULA PRÁTICA 09 – Mesoderme e Somitos
Na aula de hoje aprendemos sobre a mesoderme e somitos.
A mesoderme consiste num folheto embrionário, situado entre a endoderme e a ectoderme. A partir da mesoderme, por multiplicação e diferenciação celular, originam-se, por exemplo, o esqueleto, os músculos, e os sistemas circulatório, excretor e reprodutor.
Este folheto dá origem aos sistemas muscular, circulatório, às glândulas endócrinas e às gónadas.
Formação dos somitos
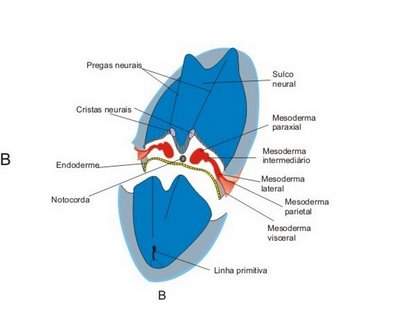
O mesoderma de cada lado da notocorda se espessa para formar as colunas longitudinais do mesoderma paraxial. A divisão dessas colunas mesodérrricas paraxiais em pares de somitos começa cefalicamente, no final da terceira semana. Os somitos são agregados compactos de células mesenquimais, de onde migram células que darão origem às vértebras, costelas e musculatura axial.
AULA TEÓRICA 09 – 3ª semana de desenvolvimento
Na aula de hoje aprendemos o processo da gastrulação bem como algumas patologias relacionadas a ela e ao tubo neural.
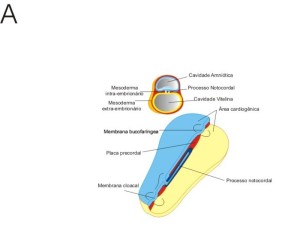
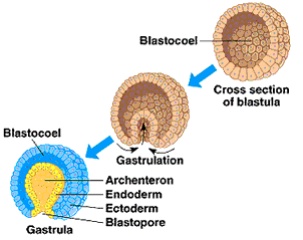
Grandes mudanças ocorrem no embrião com a sua passagem do disco embrionário bilaminar para um disco embrionário trilaminar, composto de três camadas germinativas. Este processo de formação de camadas germinativas é denominado gastrulação.

A linha primitiva
A linha primitiva aparece no início da terceira semana como um espessamento na linha média do epiblasto embrionário na extremidade caudal do disco embrionário. Ela dá origem a células mesenquimais que migram ventralmente, lateralmente e cranialmente entre o epiblasto e o hipoblasto.
Tão logo a linha primitiva começa a produzir células mesenquimais, a camada epiblástica passa a chamar-se ectoderma embrionário, e o hipoblasto, endoderma embrionário. As células mesenquimais produzidas pela linha primitiva logo se organizam numa terceira camada germinativa, o mesoderma intra-embrionário.
As células migram da linha primitiva para as bordas do disco embrionário, onde se juntam ao mesoderma extra-embrionário que recobre o âmnio e o saco vitelino. Ao final da terceira semana, existe mesoderma entre o ectoderma e o endoderma em toda a extensão, exceto na membrana orofaríngea, na linha média ocupada pela notocorda (derivada do processo notocordal) e da membrana cloacal.
Formação da notocorda
Ainda no começo da terceira semana, o nó primitivo produz células mesenquimais que formam o processo notocordal. Este se estende cefalicamente, a partir do nó- primitivo, como um bastão de células entre o ectoderma e o endoderma.
A fosseta primitiva penetra no processo notocordal para formar o canal notocordal. Quando totalmente formado, o processo notocordal vai do nó primitivo à placa procordal. Surgem aberturas no soalho do canal notocordal que logo coalescem, deixando uma placa notocordal. A placa notocordal dobra-se para formar a notocorda. A notocorda forma o eixo primitivo do embrião em torno do qual se constituirá o esqueleto axial.
Formação do tubo neural
A placa neural aparece como um espessamento na linha média do ectoderma embrionário, em posição cefálica ao nó primitivo. A placa neural é induzida a formar-se pelo desenvolvimento da notocorda e do mesênquima que lhe é adjacente. Um sulco neural, longitudinal forma-se na placa neural; o sulco neural é flanqueado pelas pregas neurais, que se juntam e se fundem para originarem o tubo neural. O desenvolvimento da placa neural e o seu dobramento para formar o tubo neural é chamado neurulação.

Formação da crista neural
Com a fusão das pregas neurais para formar o tubo neural, células neuroectodérrricas migram ventrolateralmente para constituírem a crista neural, entre o ectoderma superficial e o tubo neural. A crista neural logo se divide em duas massas que dão origem aos gânglios sensitivos dos nervos cranianos e espinhais. As células da crista neural dão origem a várias outras estruturas.
Casos clínicos:
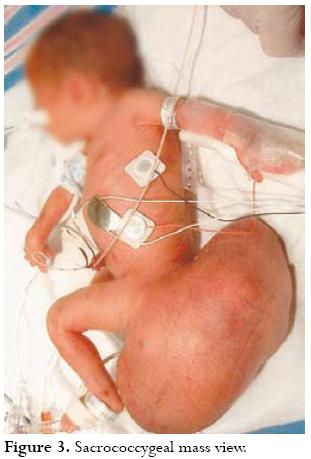
Teratoma sacrococcígeo:
O teratoma sacrococcígeo é um tumor benigno, composto pelas três camadas de células germinativas e com origem na falha de migração das células pluripotenciais que se originam no nodo de Hense. Apesar de raro, é o tumor congênito mais comum, apresentando incidência de 1 para 40.000 nascidos, sendo 75% destes pacientes do sexo feminino. O sinal inicial de um teratoma sacrococcígeo fetal pode ser o aumento uterino maior que o esperado, embora a maioria seja assintomática, só se descobrindo o tumor por meio da ultra-sonografia (US) de rotina.
A maioria desses tumores ocorre esporadicamente, embora seja descrita a ocorrência familiar. A morbi-mortalidade perinatal é alta, em conseqüência de complicações ocasionadas pelo tumor, tais como falência cardíaca, parto prematuro, anemia, distócia e ruptura do próprio tumor. O prognóstico parece estar relacionado não ao tamanho da massa, mas sim ao seu conteúdo e extensão, motivo pelo qual a ressonância magnética (RM) vem se tornando imprescindível na avaliação desses pacientes.
A US ainda é o método de escolha na avaliação fetal, pelo fato de ser um exame em tempo real, de natureza não-invasiva e de baixo custo. O diagnóstico pré-natal do teratoma sacrococcígeo pode ser obtido pela US, na qual a maioria dos tumores apresenta-se como massa sólida ou uma mistura de componentes sólidos e císticos, podendo ter, ocasionalmente, uma variante completamente cística. Os teratomas sacrococcígeos geralmente são vascularizados, o que é facilmente demonstrável com a utilização do Doppler colorido. Entretanto, a US apresenta limitações, como um campo de visão restrito, sombra acústica provocada pelos ossos pélvicos fetais, oligodramnia e obesidade materna.
fonte de pesquisa:http://www.scielo.br/scielo.php?pid=S0100-39842008000300007&script=sci_arttext&tlng=pt
Sirenomelia:
A sirenomelia (ou síndrome da sereia) é uma doença rara que resulta de uma malformação nas pernas, que se mostram unidas por uma membrana, como uma cauda de peixe.
AULA PRÁTICA 08 – Placenta (Vilosidades)
Na aula de hoje a professora revisou parcialmente o conteúdo até então dado e nos falou mais sobre a placenta. A aula foi muito proveitosa pois aprendi como a placenta é formada, que um processo um tanto complexo, e suas funções, tais como: nutrição, proteçaõ do embrião, dentre outras.
A placenta é formada através do desenvolvimento das vilosidades coriônicas primárias, secundárias, terciárias e maduras.
As vilosidades coriônicas primárias tornam-se vilosidades coriônicas secundárias, ao adquirirem um eixo central do mesênquima. Antes do fim da terceira semana, ocorre a formação de capilares nas vilosidades, transformando-as em vilosidades coriônicas terciárias.Vilosidades Maduras = as celulas do citotrofoblasto formam uma interface entre a camada decídua do endométrio e o sincicio.
Placenta hemocorial = quando as hemaceas da mãe entram no córion
AULA TEÓRICA 08 – 2ª semana de desenvolvimento
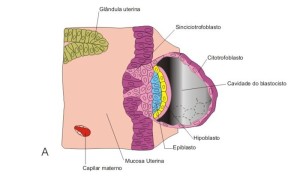
Na aula de hoje aprendemos que na segunda semana do desenvolvimento humano ocorre a diferenciação do trofoblasto em citotrofoblasto e sinciciotrofoblasto.
O citotrofoblasto, composto por células especializadas origina a porção embrionária da placenta e o sinciciotrofoblasto. Este é composto por células não individualizadas e forma o sincicio. Ele é uma estrutura invasiva com capacidade de corroer o endométrio.
Após o embrião estar imerso no endométrio, a nutrição se faz por difusão de nutrientes advindos das lacunas geradas pela invasão do sincício no estroma endometrial.
Com oito dias o embrioblasto organiza-se em: EPIBLASTO E HIPOBLASTO
Também com oito dias ocorre a formação da cavidade amniótica e do saco vitelino primario. A partir da membrana de revestimento do saco vitelino formam-se células mesenquimais que envolvem o saco amniótico e o saco vitelino formando mesoderme extraembrionaria.
Entre o 12 e o 13 dia ocorre a formação do celoma extraembrionário.
No 14 dia células do hipoblasto formam um saco vitelino menor dentro do saco vitelino primario , o saco vitelino secundario.
Aprendemos também que o mesoderme extra embrionário tem duas denominações: SOMATICO, que reveste o o trofoblasto e o saco amniótico ; e ESPLANCNICO, que reveste o saco vitelino.
O pedículo do embrião, composto por mesoderme extra-embrionário, mantém o embrião suspenso dentro da cavidade coriônica, e corresponde ao futuro cordão umbilical.
No final da implantação ocorre o estabelecimento da circulação útero-placentária inicial e a formação das vilosidades coriônicas primárias.
Essa aula foi muito importante pois podemos aprender exatamente como se desenvolve o concepto durante a segudna semana de gestação.
Nesta aula aula a professora também falou sobre alguns casos clínico q podem ocorrem durante essa etapa:
Oligodrâmnio:
Oligodrâmnio é quando o líquido amniótico, numa condição patológica, apresenta-se em quantidade diminuída, determinando um baixo ILA. Dependendo do grau, pode ser perigoso, pois o feto pode até ser ‘enluvado’ pelo saco amniótico.
Polidrâmnio:
Polidrâmnio é quando a mulher tem uma quantidade maior que o normal de líquido amniótico, sendo perigoso para sua saúde, pois distende muito seu abdômen. pode causar hipertensão tbm!
AULA PRÁTICA 07- Métodos Contraceptivos
Na aula de hoje aprendemos sobre os mais variados tipo de métodos contraceptivos. Aprendemos sobre sua funcionalidade e os riscos que eles oferecem. A aula foi produtiva e descontraida, fazendo com que tal matéria fosse por mim bem fixada.
As monitoras dividiram os métodos em comportamentais, hormonais , barreira e definitivos.
Comportamentai:
Tabelinha: A tabelinha é um método utilizado pelas mulheres para ajudar a ter uma base dos cálculos para a mulher engravidar ou não, em datas diferentes do ciclo menstrual. Basicamente a mulher é fértil no meio do seu ciclo.
Para quem quer engravidar é uma boa maneira controlar a menstruação em uma tabelinha, para saber a data da fertilização, lembrando que esse método pode não funcionar muitas mulheres ainda o utilizam.
A tabelinha tem a chance de dar certo no dia seguinte. Em um calendário anote o primeiro dia em que ocorrer a menstruação. Marque com uma cor os dias que você pode ter relações entre o 1º dia e 9º dia, contando sempre a partir o 1º dia da menstruação. Depois marque de outra cor os dias em que você não pode ter relações do 10º ao 19º, entre esses dias use uma camisinha.
fonte:http://www.blogbrasil.com.br/tabelinha
Método oriundo na observação das alterações fisiológicas da temperatura corporal ao longo do ciclo menstrual. Após a ovulação, a temperatura basal aumenta (acção da progesterona). A paciente deve medir a temperatura oral, durante 5 minutos, pela manhã (após repouso de no mínimo 5 horas) antes de comer ou fazer qualquer esforço, e anotar os resultados durante dois ou mais ciclos menstruais. Esse procedimento deve ser realizado desde o primeiro dia da menstruação até o dia em que a temperatura se elevar por 3 dias consecutivos. Depois de estabelecer qual é a sua variação normal, e o padrão de aumento, poderá usar a informação, evitando relações sexuais no período fértil. Uma grande desvantagem do método da temperatura é que se a mulher tiver alguma doença, como um simples resfriado ou virose, todo o esquema se altera, tornando impossível retomar a linha basal, ou saber se o aumento de temperatura é devido à ovulação ou a febre.
Muco cervical (estrogeno) [ Billing]:
Baseia-se na identificação do período fértil pelas modificações cíclicas do muco cervical, observado no auto-exame e pela sensação por ele provocada na vagina e vulva. A observação da ausência ou presença do fluxo mucoso deve ser diária. O muco cervical aparece cerca de 2 a 3 dias depois da menstruação, e inicialmente é pouco consistente e espesso. Logo antes da ovulação, ele atinge o chamado “ápice”, em que fica bem grudento.
Coto interrompido (não eficaz):
Baseia-se na capacidade do homem em pressentir a iminência da ejaculação e neste momento retirar o pênis da vagina. Tem baixa efetividade, levando à disfunção sexual do casal, e deve ser desencorajado.
Abstinência: 100 % seguro. Porém…..
Hormonais:
Pílula
Consiste na utilização de estrogênio associado ao progesterona, impedindo a concepção por inibir a ovulação pelo bloqueio da liberação de gonadotrofinas pela hipófise. Também modifica o muco cervical tornando-o hostil ao espermatozóide, altera as condições endometriais, modifica a contratilidade das tubas, interferindo no transporte ovular.
A anticoncepção de emergência é um uso alternativo de contracepção hormonal oral (tomado antes de 72 horas após o coito) evitando-se a gestação após uma relação sexual desprotegida. Este método só deve ser usado nos casos de emergência, ou seja, nos casos em que os outros métodos anticoncepcionais não tenham sido adotados ou tenham falhado de alguma forma, como esquecimento, ruptura da caminsinha, desalojamento do diafragma, falha na tabelinha ou no coito interrompido, esquecimento da tomada da pílula por dois ou mais dias em um ciclo ou em caso de estupro. Este contraceptivo contém o levonorgestrel, que é um tipo de progesterona. O levonorgestrel previne a gravidez inibindo a ovulação, fertilização e implantação do blastocisto.
Os anticoncepcionais hormonais injetáveis são anticoncepcionais hormonais que contém progesterona ou associação de estrogênios, para administração parenteral (intra-muscular ou IM), com doses hormonais de longa duração. Consiste na administração de progesterona isolada, via parenteral (IM), com obtenção de efeito contraceptivo por períodos de 1 ou 3 meses, ou de uma associação de estrogênio e progesterona para uso parenteral (IM), mensal.
Métodos de barreira:
Este método impede a ascensão dos espermatozóides ao útero, sendo fundamentais na prevenção das DST e AIDS. Junto com a pílula anticoncepcional e o coito interrompido, são os métodos não definitivos mais utilizados. Quase todas as pessoas podem usar; protege contra doenças sexualmente transmissíveis, inclusive AIDS; previne doenças do colo uterino; não faz mal a saúde; é de fácil acesso.
É um anel flexível, coberto por uma membrana de borracha fina, que a mulher deve colocar na vagina, para cobrir o colo do útero. Como uma barreira, ele impede a entrada dos espermatozóides, devendo ser utilizado junto com um espermicida, no máximo 6 horas antes da relação sexual.
As esponjas são feitas de poliuretano, são adaptadas ao colo uterino com alça para sua remoção e são descartáveis (ao contrário do diafragma), estão associadas a espermicidas que são substâncias químicas que imobilizam e destroem os espermatozóides, podendo ser utilizados combinadamente também com o diafragma ou preservativos. Existem em várias apresentações de espermicidas: cremes, geleias, supositórios, tabletes e espumas.
A esterilização (laqueadura tubária e vasectomia) um método contraceptivo cirúrgico e definitivo, realizado na mulher através da ligadura ou corte das trompas impedindo, o encontro dos gametas masculino e feminino e no homem, pela ligadura ou corte dos canais deferentes (vasectomia), o que impede a presença dos espermatozóides no líquido ejaculado. Quando houver indicação de contracepção cirúrgica masculina e, principalmente, a feminina deve ser baseada em critérios rígidos, observando-se a legislação vigente.
Fonte: http://texinhabio12.blogspot.com/2006/12/mtodos-contraceptivos.html
AULA TEÓRICA 07 – 1ªsemana de desenvolvimento
Na aula de hoje aprendemos sobre clivagem e implantação.
Clivagem é o nome que se dá ao processo específico de divisão celular equacional (=mitose) no ínicio do desenvolvimento embrionário, pelo qual o zigoto, também dito célula-ovo, originará a multicelulariedade do embrião.
Nos humanos, a clivagem é holoblástica, rotacional e assimétrica. Ela dá origem aos blastômeros, que irão se dividindo e so tornando cada vez menores, pois nessa fase o zigoto não cresce.
As divisões são assincrônicas e se iniciam 30 horas depois da fecundação. Até oito células são totipotentes.
Podem ocorrer error durante a clivagem, como a não disjunção durante as divisões iniciais, podendo gerar um embrião com dupla linhagem celular =mosaico. Exemplo: 1% dos casos de Síndrome de Down têm mosaicismo em diferentes proporções. Quanto menos células trissômicas, o fenótipo e menos acentuado.
Quando o zigoto apresenta aproximadamente 16 células, ele passa a sofrer um processo de Compactação , que dara origem a mórula. Essas células se manterão compactadas através de junções comunicantes realizadas por molléculas de adesão como a uvomorulina e conexina 43.
Na compactação as células mudam de forma por alterações do citoesqueleto, aumentando assim a superfície de contato entre as células.
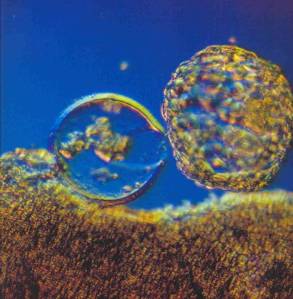
Ao chegar ao útero 4 dias após a fecundação as células sofrem diferenciação, formando o trofoblasto e o embrioblasto.
O trofoblasto forma o cório, é responsável pela nutrição do blastocisto e não entra na formação do corpo do embrião.
Já o embrioblasto forma o embrião. Também contribui para a formação do âmnio e saco vitelino.
Quatro dias após a fecundação, aparece uma cavidade inicialmente formada por flúidos produzidos pelos blastômeros em compactação, a BLASTOCELE. Ela se amplia com a entrada de Na+ na cavidade atraves da bomba Na+ / K+ ATPase presente nas células trofoblásticas.
Envolvendo o blastocisto há a zona pelucida, ela serve para manter os blastomeros unidos epara evitar q o concepto seja rejeitado pelo organismo materno. Também impede q ocorra a implantação pré- matura do embrião na parede da tuba uterina, por esconder os receptores de sperfície.
Quando estão chegando no útero as células do trofoblasto secretam a enzima STRIPSINA que degrada a Zona pelúcida . Entã o embrião ECLODE.
Após a chegada do blastocisto na cavidade uterina ( 3 a 4 dias depois da fecundação), ocorre a implantação. A professora definiu a implantaçao como sendo uma conversa molecular entre mãe e filho. Nessa fase ocorre uma série de modificações, resultando na interação entre o trofoblasto e o endométrio.
As moléculas envolvidas na implantação e adesão inicial são as seguintes:
Interleucina I, Fator inibidor da Leucemia, Fator estimulador de colônias, fator de crescimento endodérmico.
O trofoblasto então se diferencia em sincicio trofoblasto e citotrofoblasto.
Nessa aula a professora nos apresentou o seguinte caso clínico:
Para ocorrer a implantação, a parte que deve interagir com o enométrio é o trofoblasto. Porém , algumas vezes isso não ocorre, e quem vai interagir com o endométrio é o embrioblasto. Com isso somente a placenta irá se desenvolver e mesmo assim a mulher terá sintomas de gravidez e até mesmo o teste Beta-HCG indicará gravidez. Esse caso é chamado de OVO CEGO. Para diagnosticar rpecisamente é necessário a realização de uma ecografia.

Esa aula foi ótima, pois além de aprender bem a matéria , a professora Patrícia nos ensinou como agir nesses casos. O quanto é difícil explicar para a paciente que ela não está grávida, apesar de vários exames mostrarem o oposto, e como é difícil falar também para a paciente que possui apenas uma placenta em seu útero.
AULA PRÁTICA 05 – Simulação gravidez ectópica
Essa aula , na minha opinião, foi a mais produtiva de todas as aulas práticas. Não por seu conteúdo didático sobre a gravidez, que foi ótimo também, mas porque a professora Patrícia nos mostrou o quanto é difícil explicar, olhar no rosto, e até mesmo diagnosticar um paciente.
Na aula aconteceu uma insenação com as monitoras e o Gui , além de muito engraçada, foi muito , marcante. Nesta insenção as monitoras foram as pacientes e uma delas possuia gravidez ectópica. Para diagnosticar o que a paciente tinha, foi muito difícil, porque além do Dr. (Gui) estar nervoso, as pacientes esconderam algumas informações e ficaram palpitando no que poderia ser os sintomas.
A professora nos falou que estas situações são rotineiras. Esta aula fez aumentar ainda mais meu interesse pela Medicina.
AULA TEÓRICA 05 – Fecundação
Na aula de hoje aprendemos sobre fecundação. A professora Patrícia falou um pouco sobre as características, as etapas, os resultados e algumas curiosidades da fecundação.
As caracteristicas gerais podem ser assim resumidas: a fecundação ocorre na ampola uterina, inicia-se com a capacitação e aproximação dos gametas e termina com a mistura dos cromossomos maternos e paternos na metafase da primeira mitose do zigoto, tendo uma duração de 24 horas.
A fecundação é dividida em 8 etapas:
1) Capacitação
2) Atração dos gametas
3) Travessia da corona radiata
4) Reconhecimento da Zona Pelúcida
5) Reação acrossomal
6) Penetração na Zona Pelúcida
7) Fusão das membranas dos gametas
8) Ativação do OVO
Resultados da fecundação:
* Restaura o número diplóide normal de cromossomos
* Determina o sexo do futuro embrião
* Com a mistura dos cromossomos maternos e paternos, zigoto constitui célula geneticamente única
* Ativação do ovo para que se inicie o processo de clivagem
Curiosidades:
Superfecundação – É a fertilização de dois ou mais ovócitos em diferentes tempos.
- A fertilidade de homens e mulheres chega ao auge aos 24 anos
- Entre casais mantendo relações sexuais sem uso de contraceptivo, 25% das mulheres conceberão no primeiro mês, 60% dentro de seis meses, 75% dentro de nove meses, 80% dentro de um ano e 90% dentro de 18 meses.
- Depois da ovulação, um óvulo só pode ser fertilizado entre 12 e 14 horas aproximadamente.
AULA PRÁTICA 06 – Gravidez Ectópica
Hoje tivemos uma aula sobre gravidez ectópica. Nessa aula aprendemos com o professor Bruno quais são os sintomas, o que é a gravidez ectópica e ele nos falou sobre como agir quando chega alguma passiente com tal problema.
Resumidamente, a gravidez ectópica é a gestação que ocorre fora da cavidade uterina.
Os sintomas e sinais que ela apresenta são clássicos, como :
1) História de atraso menstrual seguida por sangramento vaginal normal.
2) Dor pélvica ou abdominal de intensidade variável.
3) Presença de massa palpáveldolorosa em região de anexos (trompas e ovários).
4) Sinal de Blumberg (dor na descompressão abdominal que é sinal de irritação no peritônio).
Como se faz o diagnóstico?
A gravidez ectópica pode representar uma emergência cirúrgica, portanto seu diagnóstico precoce é essencial. Na gravidez ectópica não interrompida, a paciente pode não ter sintomas ou ter sintomas mínimos.
Alguns exames podem ser realizados para diferenciar a gestação ectópica de outras doenças, tais como ameaça de aborto, gestação normal, infecções das trompas, apendicite, cisto de ovário torcido.
Os exames comumente solicitados são testes para confirmar a gravidez, exames de sangue para determinar a perda sanguínea e a presença de infecção e a ecografia pélvica transvaginal.
Podem ser necessários outros exames como a punção do fundo de saco vaginal com agulha grossa para determinar a presença de sangue dentro da cavidade abdominal e a realização de uma laparoscopia diagnóstica.
Como se trata?
O tratamento pode ser expectante naqueles casos onde a gravidez ectópica se localiza na trompa e ainda não rompeu, mede menos de 4 cm, não se constata a presença de batimentos cardíacos fetais e os níveis hormonais estão diminuindo.
O tratamento cirúrgico, que em alguns casos pode ser conservador, preserva a trompa e geralmente é realizado por laparoscopia, sendo a laparotomia uma medida muitas vezes salvadora em uma paciente com comprometimento hemodinânico (porque já houve sangramento importante para dentro da cavidade abdominal – sangramento oculto).
fonte:http://www.abcdasaude.com.br/artigo.php?220
Em procura sobre tal assunto em outro site, achei interessante o seguinte: ectópica = fora de lugar. Lá também há um dado interessante, que 1 a cada 100 a 150 gestações é ectópica.
Lá também diz que os sintomas da gravidez ectópica começam a aparecer depois de quatro semanas após o atraso do período menstrual normal.
http://saude.hsw.uol.com.br/gravidez-ectopica.htm